En injektionsflaska innehåller 5 mg eller 35 mg agalsidas beta.
| namn | Förpackningens innehåll | Den aktiva substansen | Pris 100% | Senast ändrad |
| Fabrazyme | 10 injektionsflaskor, pulver för beredning Slutgiltig lösning till inf. | Agalsidas beta | 2019-04-05 |
Handling
Agalsidas beta - en rekombinant form av humant α-galaktosidas A, producerat med rekombinant DNA-teknik med användning av kinesisk hamster äggstockscellodling (aminosyrasekvensen för den rekombinanta formen liksom nukleotidsekvensen som kodar för den är identisk med den naturliga formen av α-galaktosidas). Det är ett enzym som katalyserar hydrolysen av GL-3. Brist på dess aktivitet under förloppet av Fabrys sjukdom orsakar GL-3-lagring i många typer av celler, inklusive endotelceller och parenkymceller. Behandling med preparatet leder till en signifikant minskning av GL-3-avlagringar i njurarna, hjärtat och huden. Efter intravenös administrering rensas agalsidas beta snabbt från cirkulationen och tas upp av lysosomerna i blodkärlets endotelceller och parenkymala celler. T0,5 i eliminationsfasen är 45-100 min.
Dosering
Intravenöst. Behandlingen ska utföras av en läkare med erfarenhet av behandling av patienter med Fabrys sjukdom eller andra ärftliga metaboliska sjukdomar. Rekommenderad dos är 1 mg / kg kroppsvikt. en gång varannan vecka Hos vissa patienter, efter den initiala dosen 1 mg / kg. varannan vecka i 6 månader, en dos på 0,3 mg / kg används varannan vecka kan stödja minskningen av GL-3-avlagringar i vissa celltyper; emellertid har den långsiktiga kliniska relevansen av dessa observationer inte fastställts. Särskilda grupper av patienter. Ingen dosjustering krävs hos patienter med njurinsufficiens. Studier har inte utförts på patienter med leverinsufficiens. Säkerhet och effekt har inte fastställts hos patienter> 65 år; ingen dosregim kan för närvarande rekommenderas. Studier på barn 0-7 år har inte utförts och säkerheten och effekten av läkemedlet i denna åldersgrupp har inte fastställts; ingen dosregim kan rekommenderas. Ingen dosjustering krävs för barn mellan 8 och 16 år. Sätt att ge. Pulvret för koncentrat till infusionsvätska, lösning måste beredas med vatten för injektionsvätskor, spädas sedan med 0,9% intravenös natriumkloridlösning och administreras som en intravenös infusion. Den initiala infusionshastigheten bör inte överstiga 0,25 mg / min (15 mg / h). Om patienten tolererar medicinen väl kan infusionshastigheten gradvis ökas med efterföljande infusioner. Heminfusioner kan övervägas hos patienter som tolererar dem väl. Patienter som upplever biverkningar under heminfusioner måste omedelbart stoppa infusionen och söka vårdpersonal. Genomförande av efterföljande infusioner kan kräva kliniska tillstånd. Dosen och infusionshastigheten hemma bör hållas konstant och bör inte ändras utan tillsyn av en vårdpersonal.
Indikationer
Långvarig enzymersättningsterapi hos patienter med en bekräftad diagnos av Fabrys sjukdom (a-galaktosidas A-brist). Läkemedlet är indicerat för vuxna, ungdomar och barn ≥8 år.
Kontraindikationer
Livshotande överkänslighet (anafylaktisk reaktion) mot den aktiva substansen eller mot något hjälpämne.
Försiktighetsåtgärder
Agalsidas beta (r-hαGAL) är ett rekombinant protein, därför kan utveckling av IgG-antikroppar förväntas hos patienter med liten eller ingen kvarvarande enzymaktivitet; IgG-antikroppar mot r-hαGAL utvecklas vanligtvis hos de flesta patienter inom 3 månader från den första administreringen av preparatet. Patienter med antikroppar mot r-hαGAL löper större risk för infusionsrelaterade reaktioner och hos sådana patienter bör försiktighet iakttas vid återadministrering av agalsidas beta; antikroppsnivåer bör övervakas. För milda till måttliga infusionsrelaterade reaktioner kan läkemedelsadministrationshastigheterna minskas till 10 mg / timme och / eller förmedlas med antihistaminer, paracetamol, ibuprofen och / eller kortikosteroider. Liksom med andra intravenösa proteininnehållande läkemedel kan överkänslighetsreaktioner av allergisk typ förekomma. vid allvarliga allergiska eller anafylaktiska reaktioner ska administreringen av preparatet avbrytas omedelbart och lämplig behandling inledas. Hos patienter med avancerad njursjukdom kan njureffekten av agalsidas beta-behandling vara begränsad.
Oönskad aktivitet
Mycket vanliga: huvudvärk, parestesi, illamående, kräkningar, frossa, pyrexi, kall känsla. Vanliga: nasofaryngit, yrsel, somnolens, hypoestesi, brännande känsla, letargi, synkope, ökad lakrimation, tinnitus, perifer yrsel, takykardi, hjärtklappning, bradykardi, rodnad, hypertoni, blekhet , hypotoni, värmevallning, dyspné, nästäppa, svullnad i halsen, väsande andning, hosta, försämrad andfåddhet, buksmärta, smärta i övre buken, obehag i övre buken, obehag i magen, oral hypoestesi, diarré, klåda, nässelfeber, utslag, erytem, generaliserad klåda, angioneurotiskt ödem, ansiktsödem, makulopapulärt utslag, smärta i extremiteterna, myalgi, ryggsmärta, muskelspasmer, artralgi, muskelspänningar, muskuloskeletal stelhet, trötthet, obehag i bröstet, värmekänsla , trötthet, svullnad i extremiteterna, bröstsmärta, asteni, smärta, ansiktssvullnad, hypertermi. Mindre vanliga: rinit, hyperestesi, tremor, kliande ögon, okulär hyperemi, svullnad i örat, öronsmärta, sinusbradykardi, perifer kyla, bronkospasm, faryngolaryngeal smärta, rinorré, snabb andning, trängsel i övre kanalen Andningsvägar, dyspepsi, dysfagi, cyanosmarmorering, erytematös hudutslag, klåda i hudutslag, missfärgning av huden, obehag i huden, muskuloskeletal smärta, värme och kyla, influensaliknande symtom, smärta vid infusionsstället, reaktion på infusionsstället, trombos vid injektionsstället, illamående, svullnad. Ingen känd frekvens: anafylaktoid reaktion, hypoxi, leukocytoklastisk vaskulit, minskad syresättning. De flesta av de läkemedelsrelaterade biverkningarna kan tillskrivas IgG-antikroppsbildning och / eller komplementaktivering. IgE-antikroppar detekterades hos ett litet antal patienter. Säkerhetsprofilen hos barn (> 7 år) och ungdomar skiljer sig inte från den som ses hos vuxna.
Graviditet och amning
Det ska inte användas under graviditet, såvida det inte är absolut nödvändigt (det finns otillräckliga data om användningen av läkemedlet hos gravida kvinnor). Agalsidas beta kan övergå till bröstmjölk. Eftersom det inte finns några data om effekterna på spädbarn, bör utfodring avbrytas under behandling med beredningen.
Kommentarer
Yrsel, somnolens och svimning kan förekomma på administreringsdagen, vilket kan begränsa förmågan att framföra fordon eller använda maskiner. Förvara läkemedlet vid 2-8 grader C.
Interaktioner
Läkemedlet ska inte administreras med klorokin, amiodaron, monobenson eller gentamicin på grund av risken för hämning av intracellulär α-galaktosidasaktivitet. Med tanke på metabolismen av agalsidas beta verkar det inte vara involverat i läkemedelsinteraktioner som medieras av cytokrom P450.
Beredningen innehåller ämnet: Agalsidas beta
Ersatt läkemedel: NEJ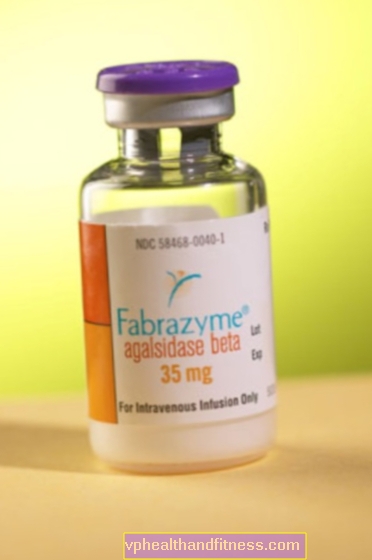

















.jpg)




